SEL GALVANI
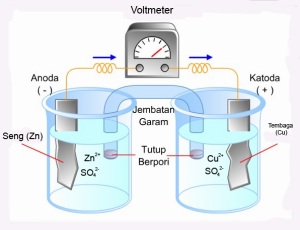
Sel galvani atau sel volta merupakan salah satu sel elektrokimia yang dapat menghasilkan energi listrik, karena terjadinya reaksi redoks secara spontan. Salah satu contoh sel galvani yaitu sel Daniell. Sel daniel yang telah dimodifikasi dapat dilihat pada gambar. Dalam suatu sel galvani perpindahan elektron terjadi secara tidak langsung (melalui kawat), karena kedua setengah reaksi dipisahkan ke dalam dua tempat yang dihubungkan dengan jembatan garam atau pembatas partisi berpori. Jembatan garam biasanya dibuat dari pipa berisi elektrolit KCl atau KNO3 yang diikatkan dengan agar-agar, yang berfungsi untuk memelihara kenetralan muatan pada masing-masing setengah sel.
Pada sel galvani masing-masing sel mengandung sebuah elektroda dan suatu elektrolit. Elektroda yang digunakan merupakan suatu konduktor listrik yang tidak bereaksi dengan larutan elektrolit. Elektroda dengan kutub negatif disebut anoda dan merupakan tempat berlangsung reaksi oksidasi, sedangkan katoda adalah elektroda dengan kutub negatif dan merupakan tempat berlangsung reaksi reduksi. cara kerka jembatan garam
Untuk menetralkan kelebihan dan kekurangan muatan ini jembatan garam yang kaya akan ion, melepaskan ion negatif pada pada sel yang mengalami reaksi oksidasi dan melepaskan ion positif pada sel yang mengalami reaksi reduksi. Misalkan jembatan garam yang digunakan adalah KNO3, maka ion NO3‾ dilepaskan pada sel yang mengalami oksidasi dan K+ dilepaskan pada sel yang mengalami reduksi.
SEL ELEKTROLISIS
Istilah elektrolisis berasal dari kata elektro (listrik) dan lisis yang berarti penguraian. Jadi secara singkat elektrolisis dapat diartikan sebagai penguraian suatu zat atau senyawa oleh orus listrik, sedangkan peralatan yang digunakan untuk elektrolisis disebut sel elektrolisis.
Pada sel galvani reaksi redoks berlangsung secara spontan dan reaksi yang terjadi disertai pembebasan sejumlah energi. Pada proses elektrolisis reaksi redoks berlangsung tidak spontan, agar reaksi redoks dapat berlangsung maka diperlukan sejumlah energi dari luar. Energi yang diperlukan pada proses elektrolisis merupakan arus listrik searah. Penguraian zat-zat elektrolit dengan arus listrik searah disebut eletrolisis.
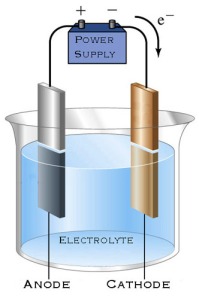
Sel elektrolisis pada dasarnya hampir sama dengan sel Galvani tetapi tidak digunakan jembatan garam dan voltmeter diganti menggunakan sumber arus (biasanya baterai). Sel elektrolisis terdiri dari dua buah elektroda yang masing-masing dihubungkan dengan kutub-kutub sumber arus dan dimasukkan kedalam bejana yang berisi zat elektrolit. Elektroda yang digunakan biasanya berupa elektroda inert (sukar bereaksi) seperti platina, karbon (grafit) dan Emas.
Elektroda yang dihubungkan dengan kutub negatif sumber arus disebut katoda (─) sedangkan elektroda yang dihubungkan dengan kutub positif sumber arus disebut anoda (+). Saat elektrolisis dilakukan ion-ion yang bermuatan positif (kation) akan teroksidasi dan menempel pada elektroda yang digunakan pada katoda sehingga apabila dilakukan penimbangan massa katoda bertambah, sedangkan ion-ion yang bermuatan negatif (anion) akan tereduksi pada anoda sehingga elektroda yang diletakan pada anoda massannya tidak berubah (tetap). Proses elektrolisis umunya terdiri dari dua tipe yaitu elektrolisis lelehan (leburan) dan elektrolisis larutan.

Tidak ada komentar:
Posting Komentar